***********************************************************************************
задание для 11 класса (19.09.16)
Завдання для самоконтролю 7 клас (10.05.16)
задание для 11 класса (19.09.16)
- Осуществите цепочки химических превращений:
А. CH4 → HCOH → CH3OH → CH3Cl → C2H6
Б. C2H2 → C6H6 → C6H5l → C6H5OH
2. Решите задачи:
А. Найдите молекулярную формулу углеводорода, массовая доля
водорода в котором составляет 15,79%. Относительная плотность паров этого
вещества по воздуху равна 3,93.
Б.Найдите молекулярную формулу углеводорода, массовая доля
углерода в котором составляет 81,8%. Относительная плотность вещества по азоту
равна 1,57.
Завдання для самоконтролю 7 клас (10.05.16)
1.
Позначте правильне твердження: розчин-це:
А
хімічна сполука;
Б
однорідна система двох або кількох компонентів;
В
механічна суміш; Г
суміш елементів.
2.
Визначте
відносну молекулярну масу води
А 20; Б
18; В 17; Г 16.
3.
Вкажіть
воду, що містить найменше домішок:
А дощова; Б річкова;
В джерельна;
Г дистильована
4.
Встановіть
відповідність між реагентами і продуктами реакції?
А Li+H2O→ 1 Ca(OH)2
Б C+ H2O→ 2 LiOH
В SO3+ H2O→ 3 CO2+H2↑
Г CaO+ H2O→ 4 2LiOH+ H2↑
5 H2SO4
5.
До води
масою 114г додали ZnCI2 масою 6г. Яка масова частка цинк хлориду в
утвореному розчині?
6.
Яку масу
прісної води треба додати до морської води, щоб зменшити масову частку солі в
ній у 2 рази?
*******
Подготовка
к контрольной работе (9 класс)
Повторите
учебный материал § 16-35
1.
Выполните тестовое задание:
1.
Определите
тип реакции, наиболее характерный для алканов: а) Присоединение; б) Замещение;
в) Полимеризация; г) Соединение
2.
Выберите
утверждение, характеризующее процесс галогенирования алкенов: а) Отщепление;
атомов галогена; б)Отщепление галогеноводорода; в)Присоединение
галогеноводорода; г)Присоединение атомов галогена
3.
Укажите
общую формулу класса алкинов: а)CnH2n+2 ; б) CnH2n
; в) CnH2n-2 ; г) CnH2n-6
4. Функциональная группа спиртов - это: а) –СООН; б)- ОН; в) –СОН; г) –NO2;
5. Глицерин в природе находится в составе: а) жиров; б) белков; в) углеводов; г) нуклеиновых кислот;
6. Укажите общее название солей уксусной кислоты: а)
карбонаты; б) ацетаты; в) формиаты; г) алкоголяты;
7. В основе производства маргарина лежит процесс: а)
гидролиза жиров; б) гидратации жиров; в)гидрирования жиров; г) дегидрирования
жиров;
8. Укажите тип реакции, с помощью которой получают
эстеры: а) полимеризация; б) изомеризация; в) циклизация; г) эстерификация;
9. Моносахаридом является: а) лактоза; б) глюкоза; в)
целлюлоза; г) сахароза;
10. Первичная структура --- это: а) последовательность
аминокислот в белке; б) аминокислотный состав белка: в) молекулярная формула
белка;г) строение a-спирали белка;
11. Определите тип реакции, наиболее
характерный для алкенов: а) Присоединение; б) Замещение; в) Полимеризация; г)
Соединение
12. Выберите утверждение,
характеризующее процесс гидрогалогенирования алкинов: а) Отщепление; атомов
галогена; б)Отщепление галогеноводорода; в)Присоединение галогеноводорода;
г)Присоединение атомов галогена
13. Укажите общую формулу класса
алканов: а)CnH2n+2 ; б) CnH2n ; в)
CnH2n-2 ; г) CnH2n-6
14. Функциональная группа карбоновых кислот - это: а) –СООН; б)- ОН; в) –СОН; г) –NO2;
15. Аминокислоты в
природе находится в составе: а) жиров; б)
белков; в) углеводов; г) нуклеиновых кислот;
16. Укажите общее название солей метановой кислоты: а) карбонаты; б) ацетаты; в) формиаты;
г) алкоголяты;
17. В основе производства мыла лежит процесс: а) гидролиза жиров; б)
гидратации жиров; в)гидрирования жиров; г) дегидрирования жиров;
18. Укажите тип реакции, с помощью которой получают
полиэтилен: а) полимеризация; б) изомеризация; в) циклизация; г) эстерификация;
19. Полисахаридом является: а) лактоза; б) глюкоза; в)
целлюлоза; г) сахароза;
20. Какую связь называют пептидной?
а) ---СО---О-- б) ---СО---NН--- в)---СО---NH2---
г)----СООН---NH2-----
задачи
1. Определите
молекулярную формулу углеводорода, если относительная плотность этого вещества
по воздуху равна 2.69, а массовая доля углеводорода равна 0.923.Относительная
плотность органического соединения по водороду равна 30.
2. Определите
молекулярную формулу этого вещества, если массовая доля углерода в нем равна
40%, водорода 6,7%, кислорода 53.3%"
3. Определите
молекулярную формулу углеводорода, если массовая доля углерода равна 85,7%, а
водорода - 14,3%. Относительная плотность этого вещества по азоту равна
примерно 2.
4. Определите
молекулярную формулу вещества, если его плотность при н.у. равна 1, 4285 г/л,
массовая доля углерода равна 0,375, водорода - 0,125, кислорода - 0,5."
*****Домашняя работа 10 класс (25.04.16)
Общие сведения о металлах и их
соединениях
Вариант №3
Задание
№1.
Выберите
правильный ответ:
1. Известковая вода является реактивом на: а)
углекислый газ, б) кислоты, в) щелочи.
2.
При
взаимодействии гидроксида алюминия с щелочью наблюдаем: а) образование осадка,
б) растворение осадка, в) изменений нет.
3.
В химических
реакциях натрий и калий проявляют свойства: а) амфотерные, б)
восстановительные, в) окислительные
4.
Главная алюминиевая руда Al2O3 * n H2O
называется: а)алюмосиликат, б) боксит, в) корунд
5.
Железо с
серой реагирует а) при обычных условиях, б) при нагревании, в) со взрывом.
6.
Железо при
обычных условиях –металл: а) черный блестящий, б) серебристо-белый тугоплавкий,
в) мягкий пластичный, но не проводит тепло.
7. При растворении в воде негашеной извести
наблюдаем: а) бурное протекание реакции с сильным разогреванием, б) появление
пузырьков газа, в) медленное протекание реакции.
8.
Пассивируют
алюминий кислоты: а) соляная, б) разбавленная серная, в) концентрированная
азотная.
9. Натрий
хранят под слоем керосина, т.к. он: а) взрывоопасен, б) легко
окисляется, в) разлагается на свету.
10. Минерал Fe3О4 ,
содержащий железо называется: а) пирит, б) магнетит, в) сидерит.
Задание №2
Составьте уравнения реакций:
Na + Cl2 →
CaО + CO2→
Al Cl3 + Na ОН
→
Fe(ОН)2 + O2 + H2O →
Задание №3
Составьте уравнения реакций в соответствии со схемой
превращений:
К →К2 О→К ОН→К→ К 2S → К Cl→ К NO3
Реакцию а) рассмотрите как окислительно-
восстановительную; реакцию д) запишите в ионном виде.
Задание №4Решите задачу:
Вычислите объём газа, который выделится при реакции железа(III)
массой 11,2 г
с серной кислотой.
Задание №5.
Решите задачу:
Какой объём водорода (при н.у.) потребуется для
восстановления алюминия из боксита
массой 300 г ,
в котором содержится 75 % Al2О3?
*******
11 класс (на 20.04.16)
11 класс (на 20.04.16)
Домашняя контрольная работа
Органические соединения
1.Выполните тестовые
задания:
1. Укажите функцию белков,
которые принадлежат к ферментам:а) образуют опорные мышцы и ткани организмов.
б) транспортируют питательные вещества. в) катализируют химические процессы в
организме, г) защищают организм от болезней
2. Укажите правильное
окончание утверждения: «Реакция омыления – это процесс: а)взаимодействия
моющего средства с жиром, б) образования мыла из карбонових кислот, в)
взаимодействия жиров с растворами щелочей,
г) гидролиз жиров под действием щелочей.
3.
Какое
из названных ниже средств бытовой химии при неосторожном обращении с ним может
вызвать химический ожог на коже? а) освежитель воздуха ( аэрозоль, содержащий
пропан), б) моющее средство для стекол (жидкость, содержащая глицерин), в)
средство для прочищения канализационных труб (гранулы натрий гидроксида)
г) удобрение для комнатных растений ( гранулы натрий нитрата).
4. Укажите
процесс, который лежит в основе производства маргарина: а) дегидрирование жира,
б) гидрирование жира, в) гидратация жира, г) гидролз жира.
5.
Укажите
вещества, которые являются наркотическими: а)аскорбиновая кислота, б) морфин,
в) никотин, г) каучук.
6.
Укажите правильное утверждение «Гидролиз жиров в технике
применяют для получения…»: а)глицерина, б) этанола, в) карбоновых, г) эстеров.
7.
Фреоны
образуются в результате: а) сгорания мусора, б) нефтехимического производства,
в) применения аэрозольных баллончиков, г) сельскохозяйственного производства.
8.
Выберите неврологические изменения, которые происходят в организме при
употреблении алкоголя:
а) потеря сознания; б) улучшение работы сердца;
в) сосояние нервного возбуждения; г) быстрое изменение настроения; д) улучшение
интеллектуального развития; є) раннее старение; ж) омоложение организма.
2. Установите соответствие:
А) между названием полимера и его применением
Полимер
|
Применение
|
1. полистирол
|
А) посуды, игрушки
|
2. тефлон
|
Б) посуда с антипригарным покрытием
|
3. полипропилен
|
В) линолеум
|
4. поливинилхлорид
|
Г) рыболовные сетки
|
Б) между
хозяйственной деятельностью человека и опасными веществами, которые образуются
в результате этой деятельности:
Деятельность
|
Последствия
|
1. применение аэрозолей
|
А) пестициды
|
2. сельское хозяйство
|
Б) фреони
|
3. сгорание мусора
|
В) диоксины
|
4. нефтехимическое
производство
|
Г) фенолы
|
В) между Е- добавками и их функциями:
Е
|
Функции
|
302
|
Антиокислитель
|
510
|
Усилитель вкуса
|
605
|
Эмульгаторы
|
910
|
Пеногасители
|
102
|
Красители
|
450
|
Стабилизаторы
|
3. Напишите уравнения реакций по схеме:
этановая кислота→хлорэтановая
кислота→аминоэтановая кислота→
белок (дипептид)
4.
Решите задачу: Препараты спиртового раствора
йода 5-10% широко применяются в медицине
как антимикробное и противогрибковое
средство. Рассчитайте, какой объем спирта ( плотность 0,8 г/мл) потребуется для
получения 30 г 5 % раствора иода?
*******8 класс
(на 19.04.16)
Домашняя
контрольная работа
Задание №1. (2б)
Тест
1. У атомов одного химического
элемента: а) одинаковое количество нейтронов в ядре; б) одинаковая масса; в)
одинаковый заряд ядра.
2. Протонное число – это: а) количество
электронов; б) количество протонов; в) количество нейтронов.
3. Какое максимальное количество
электронов может находиться на S- подуровне: а) 8; б)2; в) 18.
4. Количество электронов в атоме
равно: а)количеству нейтронов; б) количеству протонов; в) атомной массе.
5. Высшая валентность элемента
определяется: а) по номеру периода; б) по порядковому номеру; в) по номеру
группы.
6. количество энергетических уровней
можно определить : а) по номеру периода; б) по порядковому номеру; в) по номеру
группы.
7. В
периодах с увеличением атомных масс элементов: а) металлические свойства
усиливаются; б) неметаллические свойства усиливаются; в) заряд ядра
уменьшается.
8. В группах с увеличением атомных
масс элементов: а) металлические свойства усиливаются; б) неметаллические
свойства усиливаются; в) заряд ядра уменьшается.
9. Изменение свойств элементов в
группах зависит: а) от количества электронов во внешнем уровне; б) от
количества уровней; в) от количества неспаренных электронов.
10. Изменение свойств элементов в периодах зависит: а) от количества электронов
во внешнем уровне; б) от количества уровней; в) от количества неспаренных
электронов.
(по 0,2
б за каждый пункт)
Задание №2. (3 б)
Ответьте
на вопросы:
1. Расположите химические элементы
1)
Mg, Na, Si, Al, P, Cl, S в порядке увеличения атомных масс
2.
Сумма
чисел протонов, нейтронов и электронов в атоме равна 134, причем число
нейтронов превышает число электронов на 11. Напишите название элемента.
3. По положению в периодической
системе определите, у какого элемента
неметаллические свойства выражены сильнее – у серы или хлора? Почему?
4. Два атома имеют одинаковое число протонов,
но разное число нейтронов в ядре. Как они называются по отношению друг к другу?
5. По электронной формуле 1s22s22p63s23p6 3d104s2 определите
положение элемента в периодической системе. Определите к какому семейству
принадлежит этот элемент.
6. Определите, какой элемент имеет
следующую электронную формулу: 1s 22s 22p 63s 23p4, укажите число протонов, электронов и нейтронов в
ядре этого атома.
(по
0,5 б за каждый пункт)
Задание №3. (3б)
Дайте характеристику элемента №19 по его положению в периодической
системе и строению атома. Для этого:
а)
определите положение элемента в ПС ( № п/п, период, группа);
б) запишите формулу нуклида, определите заряд
ядра, количество протонов,электронов и нейтронов;
в)
зарисуйте схему строения атома, электронную конфигурацию, графическую формулу;
определите высшую и низшую валентности;
г)
определите:
число
неспаренных электронов
число
электронов, которые атом отдает или принимает для завершения уровня
д)
сделайте вывод о свойствах элемента
е)
составьте формулу высшего оксида, высшего гидроксида и летучего водородного
соединения, определите их характер
(по 0,5
б за каждый пункт)
Задание №4. (2б)
Решите
задачи:
1.
Высший оксид элемента V группы содержит 56,34 % кислорода. Определите
формулу оксида. (1б)
2.
Водородное соединение элемента V группы содержит 3,84% водорода. Определите
элемент (1б)
*******10 класс
Материалы
для подготовки к
семинару
« Развитие
металлургических производств в Украине»
(На
18.04.16)
ПОНЯТИЕ О МЕТАЛЛУРГИИ.
Металлургия
наука
о промышленных способах получения металлов.
Черная ___________________________________________
Цветная___________________________________________
Металлургические процессы протекают в несколько стадий
|
|||
В современной технике наибольшее применение находят сплавы железа.
- Чугун- это сплав железа, содержащий более 1,7% углерода, а также кремний, марганец, небольшие количества серы и фосфора.
- Сталь-это сплав железа, содержащий менее 1,7% углерода и небольшие количества кремния, фосфора, марганца и серы.
Производство чугуна
Сырьё: железная руда.
Вспомогательные
материалы: кокс (иногда природный газ), воздух, обогащённый
кислородом, флюсы (известняк, доломит).
Смесь руды, кокса и флюса называется шихтой.
Основной химический процесс:
1.Сгорание кокса, образование оксида углерода
(II).
Кокс служит источником теплоты, а также
используется для получения восстановителя – оксида углерода (II).
Под действием воздуха, обогащённого кислородом, кокс
(С)- сгорает. В результате экзотермической реакции температура достигает 18500.
C+O2=CO2+402
кДж
Образующийся углекислый
газ CO2, соприкасается с раскалённым углем С и реагирует с ним:
C+CO2=2CO
Оксид углерода(II)
является основным восстановителем железа из его оксидов.
2.
Восстановление железа, образование чугуна.
Основной процесс - восстановление железа из его
оксидов. Этот процесс происходит последовательно:
Fe2O31→Fe3O42→FeO3→Fe
3Fe2O3+CO=2Fe3O4+CO2
Fe3O4+CO=3FeO+CO2
FeO+CO=Fe+CO2
Суммарное уравнение:
Fe3O4+4CO=3Fe+4CO2
Побочный процесс – восстановление элементов
(марганца, кремния, фосфора), содержащихся в железной руде
MnO2+2CO=Mn+2CO2
SiO2 +2CO=Si+2CO2
P2O5+5CO=2P+5CO2
Восстановленное железо в жидком состоянии растворяет
марганец, кремний, фосфор, при этом образуется жидкий чугун.
3.Выведение примесей при помощи флюсов.
Флюс превращает, пустую породу в легкоплавкие
соединения – шлаки.
При разложении известняка или доломита образуется
оксид кальция
CaCO3=CaO+CO2-178кДж
MgCO3=MgO+CO2
С образовавшимся оксидом кальция взаимодействуют
тугоплавкие примеси, которые выводятся в виде шлаков.
CaO+SiO2=CaSiO3
Технологический процесс:
Чугун получают в специальных печах - домнах. Доменная печь – сложное сооружение
высотой более 30 м ,
с внутренней обкладкой из огнеупорного кирпича и стальным внешним кожухом. Верхняя
часть домны называется шахтой, верхнее отверстие – колошником, средняя, самая
широкая часть - распаром, нижняя – горном. В верхнюю часть домны (колошник)
подают шихту, а в нижнюю (горн) продувают противотоком предварительно нагретый
воздух.
Основной продукт –чугун. Различают: передельный
чугун – для производства стали, литейный –для изготовления поршней, цилиндров,
деталей автомобилей и т.д., легированный – для изготовления деталей паровых
котлов, печной арматуры, газотурбинных установок.
Побочные продукты: шлак, колошниковый газ. Шлак
используют при производстве гравия, щебня, цемента, шлаковой ваты, колошниковый
га - для обогрева воздухонагревателей.
??? Выполнить
задания:
1.Дайте определения следующим понятиям:
домна
чугун
щихта
2. Заполни таблицу:
Участники
доменного процесса
|
Роль в
доменном производстве
|
Компоненты
шихты:
|
|
Воздух,
обогащенный кислородом
|
|
Шлак
|
|
Доменный
газ
|
3.Запиши уравнения реакций химических процессов,
которые происходят в доменной печи:
- процесс
сгорания кокса;
- восстановление
железа;
- выведение примесей
- 4. Охарактеризуйте научные принципы производства чугуна:
- Непрерывность процесса
- Обогащение сырья
- Применение теплообмена
- Автоматизация и химизация процессов
- Принцип противотока
5.Как в доменном
процессе решается проблема снижения загрязнения окружающей среды?
Металлургия
Украины — базовая отрасль народного хозяйства Украины, обеспечивает более
25 % промышленного производства государства (96 955,5 млн гривен в 2005
году), дает около 40 % валютных поступлений на Украину и более
10 % поступлений в государственный бюджет Украины. В мировом производстве чёрной металлургии доля Украины, по данным
Международного института чугуна и стали, составляет 7,4 % (2007 год).
Металлургия Украины это предприятия и организации горно-металлургического
комплекса, который объединяет не только предприятия чёрной и цветной
металлургии, но и горно-обогатительные комбинаты, ферросплавные заводы,
обогатительные фабрики, коксохимические заводы, предприятия выпускающие изделия
из металлов.
Украина
является одним из лидеров стран-производителей черных металлов в мире и
занимает 7 место по объёму производства стали и 3 место — по объёму
экспорта металлопродукции. Часть продукции, производимая металлургическими
предприятиями, составляет 30 % в общем промышленном производстве и
составляет 42 % от общих объёмов экспорта Украины. Свыше 80 %
металлопродукции экспортируется в страны Европы, Азии,
Ближнего Востока, Южной Америки.
- Приазовье (более трети украинского
производства агломерата, чугуна, стали, проката, более 12 % кокса,
около 6 % стальных труб), — город Мариуполь, 3 металлургических комбината
(Мариупольский металлургический комбинат имени
Ильича,
Металлургический комбинат «Азовсталь»), коксохимический завод
«Маркохим».
- Донбасс (около 40 % кокса,
1/6 — 1/8 производства чугуна, стали, проката, 16 % стальных
труб, треть метизов, 5 % агломерата), — города Донецк, Макеевка, Енакиево, Краматорск, Константиновка, 5 металлургических заводов (Макеевский
металлургический завод или ММЗ, Донецкий металлургический завод или ДМЗ, Енакиевский металлургический завод или ЕМЗ, Краматорский и
Константиновский металлургические заводы), крупнейший в Европе Авдеевский
коксохимзавод, Макеевский и Ясиновский
КХЗ (оба
в городе Макеевка), «Донецккокс», Енакиевский коксохимпром, Харцызский трубный завод, «Силур
(компания)», Дружковский метизный завод, «Энергомашспецсталь», Донецкий металлопрокатный завод, Артемовский завод цветных
металлов, Никитовский ртутный комбинат, «Укрцинк», Торезтвердосплав,
Докучаевский флюсодоломитный комбинат, Белокаменский огнеупорный завод.
??? Охарактеризуйте один из регионов (Донецкий,
Приднепровский, Карпатский) по плану:
- Географическое положение региона
- Сырье и топливо- энергетическая баз
- Основные центр
- Вывод
Проблема
безотходных производств в металлургии и охрана окружающей среды
Безотходная технология-способ производства, при
котором рационально используются все компоненты сырья и энергии в цикле:
↑→
потребление→→→↓
Сырьевые ресурсы→производство→отходы→вторичные
ресурсы
Мероприятия
по охране окружающей среды
в
металлургии
- замена
кокса и карбон(II) оксида водородом при восстановлении;
- применение
отходящих газов как топлива;
- установление
фильтров для улавливания пыли и газов (CO,NO,NO2,SO2,H2S,CO2);
- выделение
ценных продуктов из сырья и их использование;
- использование
отходов производства как сырья для других производств;
- внедрение
бездоменного производства восстановления железа и производства стали;
- сокращение
количества стадий производственного процесса;
- создание
комбинатов.
Источники загрязнения
- Предприятия
черной и цветной металлургии;
- Горнодобывающая
промышленность;
- Тепловые
электростанции;
- Предприятия
для сжигания мусора;
- Химическая
промышленность;
- Автомобильный транспорт Основные загрязнители:
- оксиды CO,NO,NO2,SO2, CO2 ,
- газообразный H2S,
- пыль,
- соединения металлов,
- органические соединени
??? ответьте на вопросы :
- Какие вещества, образующиеся при производстве чугуна и стали, оказывают отрицательное воздействие на окружающую среду?
- В чем проявляется принцип безотходного производства стали ? В чем заключаются достоинства и недостатки этого производства?
- В каких областях Украины наиболее развито металлургическое производство?
- Какие газы являются основным источником загрязнения атмосферы?
- Как защитить воздух от загрязнения этими газами?
- Укажите наиболее важные на ваш взгляд различия между доменным процессом и производством стали.
- Поясните принцип организации безотходного производства на примере получения меди из медного блеска
- Назовите наиболее важные сферы применения металлов и сплавов
- Охарактеризуйте развитие черной металлургии в Украине
- В результате каких реакций на предприятиях цветной металлургии образуется SO2
*******
Задание для 9 класса ( на 13.04.16)
Таблица
Сравнительная характеристика важнейших углеводов
Характеристика
углеводов
|
Важнейшие углеводы
|
|||
Глюкоза
|
Сахароза
|
Крахмал
|
Целлюлоза
|
|
Строение
молекул
|
||||
Нахождение
в природе
|
||||
Получение
|
||||
Физические
свойства
|
||||
Химические
свойства
|
||||
Биологическая
роль
|
||||
Применение
|
||||
Навчальні проекти для 7 класу
1. Хімічні знання в
різні епохи.
2. Хімічні явища в природному
довкіллі
3. Хімічні явища в побуті
4. Використання хімічних явищ у
художній творчості й народних ремеслах
5. Речовини і хімічні явища в
літературних творах і народній творчості
6. Проблема забруднення повітря та
шляхи розв’язування її
7. Дослідження зміни концентрації вуглекислого газу
у класній кімнаті під час занять
8. Проблема збереження чистоти
водойм
9. Дослідження якості води з різних джерел
10. Дослідження фізичних і хімічних властивостей води
11. Способи очищення води в побуті
11. Способи очищення води в побуті
(титульный лист)
Практическая работа № 1
по химии
ученика(цы) 11 --- класса
Артемовской общеобразовательной
школы І-ІІІ ступеней №18
Фамилия Имя
_________________________________________________________________
Практическая работа №1
Удаление загрязнений
с поверхности ткани
Цель: закрепить знания о волокнах и
растворителях, формировать умения удалять с поверхности ткани загрязнения (
пятна) разного происхождения в бытовых условиях.
Реактивы и оборудование: образцы тканей с
загрязнениями разного происхождения, глицерол, нашатырный спирт, этанол, вода,
уксусная кислота, раствор мыла, бензин, стиральный порошок, пробирки,
пробиркодержатель, нагревательный прибор,спички, фарфоровые чашки, химические
стаканы, вата.
Задание № 1. Удалите с поверхности ткани пятна от чернил и растительного масла.
Задание № 2. Проверьте действие кипятка на пятна от фруктов и
ягод.
Задание № 3. Ознакомьтесь со способами удаления пятен от
ржавчины и на практике докажите из результативность.
Задание № 4. Проверьте эффективность удаления пятен от чая
кислотой и спиртом, сделайте вывод о целесообразности их использования для
удаления пятен в поверхности тканей разной природы.
Результаты работы оформите в виде таблицы:
Загрязнитель
|
Действия
по удалению пятна
|
Полученный
результат
|
Сделайте вывод:
- Какие методы удаления пятен следует применять для определенных видов загрязнений ткани?
- Какие физические и химические процессы происходят при удалении пятен моющими средствами и растворителями?
- Объясните, чем может отличаться друг от друга удаление с поверхности ткани свежих загрязнений и застаревших?
*******
Практическая
работа №2
по
химии
ученика(цы) 10 --- класса
Артемовской
общеобразовательной
школы
І-ІІІ ступеней №18
Фамилия
Имя
………………………………………………………………………………………
Практическая работа № 2
Решение экспериментальных задач
Цель: закрепить и
применить на практике знания о химических свойствах металлов в ходе
качественного определения веществ при решении экспериментальных задач
Реактивы:_________________________________________________________________________________________________________________________________________________________Оборудование:_____________________________________________________________________________________________________________________________________________________
С правилами безопасности ознакомлен
(а)____________________________
Задание:
- Исходя из цинка, получите цинк хлорид.
- Реакцией обмена получите алюминий гидроксид и докажите, что Al(OH)3 является амфотерным основанием.Ответ подтвердите написанием уравнений химических реакций.
- Осуществите взаимодействие веществ по схеме:
- Феррум(ІІІ)оксид→феррум (ІІІ)хлорид→феррум (ІІІ) гидроксид→феррум (ІІІ) нитрат
Выполнение работы:
Опыт
№1.
Для того, чтобы получить_________________ из________________________,
необходимо_________________________________________________________________
Наблюдаем_________________________________________________________________
Уравнение__________________________________________________________________
Выводы:___________________________________________________________________
Опыт
№2.
Для того, чтобы получить_________________ из________________________,
необходимо_________________________________________________________________
Чтобы доказать амфотерный характер соединения,
необходимо______________________
Наблюдаем__________________________________________________________________
Уравнение___________________________________________________________________
Выводы:_____________________________________________________________________
Опыт
№3. Для
того, чтобы получить
А)_________________
из______________________________________________________,
необходимо_________________________________________________________________
Наблюдаем_________________________________________________________________
Уравнение__________________________________________________________________
Б)_________________
из______________________________________________________,
необходимо_________________________________________________________________
Наблюдаем_________________________________________________________________
Уравнение__________________________________________________________________
В)_________________
из______________________________________________________,
необходимо_________________________________________________________________
Наблюдаем_________________________________________________________________
Уравнение__________________________________________________________________
Выводы:____________________________________________________________________
Общий
вывод:________________________________________________________________
*******задание 10 класс
Тест по теме «Металлы»
1 вариант
- Метод получения металлов путем сплавления
алюминия с оксидами металлов называется: а) ферротермией, б)
алюминотермией, в) оксидацией.
- Главная алюминиевая руда Al2O3 * n H2O
называется: а)алюмосиликат, б) боксит, в) корунд
- Алюминий –металл: а) серебристо-белый,
легкоплавкий, б) тугоплавкий, плохо проводит электрический ток, в)
пластичный, хорошо растворим в воде.
- Алюминий при обычных условиях не реагирует с:
а) водой, б) хлором, в) щелочами.
- Пассивируют алюминий кислоты: а) соляная, б)
разбавленная серная, в) концентрированная азотная.
- Высокая коррозионная стойкость алюминия
обеспечивается: а) тонкой оксидной пленкой, б) способностью
намагничиваться, в) химической
пассивностью.
- Гидроксид алюминия обладает свойствами: а) кислотными,
б) основными, в) амфотерными.
- При взаимодействии гидроксида алюминия с
щелочью наблюдаем: а) образование осадка, б) растворение осадка, в)
изменений нет.
- Оксид и гидроксид алюминия называют
амфотерными, потому что они: а) белого цвета, б) взаимодействуют только с
кислотами, в)взаимодействуют с кислотами и щелочами.
- При взаимодействии натрия с водой выделяется:
а) водород, б) кислород, в) хлор.
2
вариант
1.
Натрий входит
в состав минерала: а) сильвинит, б) магнетит, в) рубин.
2.
Калий
взрывается при соприкосновении с: а)хлором, б) бромом, в) фтором.
3.
При
растворении натрия в воде соблюдаются меры предосторожности6 а) из-за
возможности самовоспламенения водорода, б) из-за разбрызгивания жидкости, в)
опасности нет.
4.
На воздухе
натрий покрывается: а) ржавчиной, б) пероксидом натрия, в) оксидом натрия.
5.
Металлический
натрий – металл: а) желтого цвета, хорошо растворимый в воде, б)
серебристо-белый, мягкий и легкоплавкий, в) легкий, тугоплавкий.
6.
В химических
реакциях натрий и калий проявляют свойства: а) амфотерные, б)
восстановительные, в) окислительные.
7.
Натрий и калий в промышленности получают: а)
алюмотермией, б) восстановлением из солей, в) электролизом.
8. Натрий
хранят под слоем керосина, т.к. он: а) взрывоопасен, б) легко
окисляется, в) разлагается на свету.
9. В состав минерала гипс входит: а)кальций,
б)железо, в)алюминий.
10. Известковой водой называется: а) взболтанная в воде суспензия гашеной
извести, б) серый порошок гидроксида кальция, плохо растворимый в воде, в)
бесцветный прозрачный раствор гашеной извести.
Задание
11 класс (сдать 15.03.16)
Лабораторный
опыт № 7
«Ознакомление
с содержанием этикеток к пищевым продуктам»
Ø Проанализируйте этикетки к пищевым продуктам (не менее двух).
Задание № 1.
Прочитайте текст этикетки, выясните:
а) состав;
б) пищевую ценность;
в) применение добавок (если они есть,
то как называются и какие содержат Е-числа);
г) срок хранения.
Задание №2.
Пользуясь таблицей учебника и дополнительной
информацией, составьте перечень обозначений и названий не менее пяти пищевых
добавок в составе продуктов, имеющихся дома. Выясните, какую функцию выполняет
каждая из них, к каким негативным последствиям может привести употребление
продуктов с такими пищевыми добавками.
Ø Результаты исследования оформите в виде таблицы.
Ø Сделайте взвод о пригодности даннях продуктов к
употреблению.
Ø Работу оформите следующим образом:
Работа по химии
ученика (ученицы) 11 А класса
Артемовской ОШ І-ІІІ ступеней №18
Фамилия Имя в родительном падеже
Лабораторный
опыт № 7
«Ознакомление
с содержанием этикеток к пищевым продуктам»
Цель работы:……………………………………………………………………………………
Оборудование:…………………………………………………………………………………
С правилами БЖ ознакомлен(а) …………………………………………………………………….
Выполнение работы:……………………………………………………………………………..
……………………………………………………………………………………………………
Результаты исследований:
№
|
Пищевой
продукт
|
Содержание
основних продуктов
|
Пищевая ценность
|
Срок хранения
|
Содержание
пищевых добавок
|
||||||
белки
|
жиры
|
углеводы
|
витамины
|
название
|
код
|
функция
|
Последствия употребления
|
||||
1.
|
|||||||||||
2.
|
|||||||||||
Выводы:……………………………………………………………………………………………
Лабораторный й опыт №8
Ознакомление с содержанием инструкций к товарам бытовой химии
Ø Ознакомьтесь с
инструкцией к товарам бытовой химии
Ø Заполните таблицу;
Ø Ответьте на
вопросы:
·
Какую информацию содержат инструкции?
·
Чем обусловлены предостережения, которые приведены в
инструкциях?
·
Что в этих инструкциях вы считаете самым важным?
Ø Сделайте взвод о
целесообразности инструкции на упаковках товаров бытовой химии.
Ø Работу оформите следующим образом:
Работа по химии
ученика (ученицы) 11 А класса
Артемовской ОШ І-ІІІ ступеней №18
Фамилия Имя в родительном падеже
Лабораторный й опыт №8
Ознакомление с содержанием инструкции к одному из товаров бытовой химии;
Цель:……………………………………………………………………………………….
Оборудование:…………………………………………………………………………….
Выполнение работы:
С правилами БЖ ознакомлен(а) …………………………………………………………………….
Этикетка к продукту бытовой химии ___________________________
(название
продукта)
Полное название
средства
|
Состав (указать
опасные компоненты)
|
Способ применения
|
Условия хранения
|
Вредное воздействие
на организм
|
Степень
опасности (безопасные, относительно безопасные, ядовитые, огнеопасные)
|
Контрольные
вопросы:…………………………………………………………………………………………………………………………………………………………………………………………………..
Вывод:……………………………………………………………………………………………
**************
Матеріал для самостійного
опрацювання (7 клас)( на 17.03.16)
Озон.
Озон – одна з алотропних форм
кисню. Молекула складається з трьох атомів оксисену.
Фізичні властивості: озон – синій газ, має характерний своєрідний запах; молекулярна маса 48,
температура плавлення 192,7 ° C, температура кипіння = 111,9 ° C. Рідкий і
твердий озон вибухові, токсичний, добре розчинний у воді: при 0 ° C в 100
об’ємах води розчиняється до 49 об’ємів озону.
Хімічні
властивості: Озон є більш сильним окисником, аніж
молекулярний кисень. Має дуже високу реакційну
здатність .Майже всі реакції, які проходять піддією кисню, проходять також з озоном,
але при цьому реакція протікає швидше й виділяється більша кількість
енергії.
Знаходження в природі: в атмосфері озон утворюється під час грози,
коли відбуваються електричні розряди.
Застосування: Застосування озону зумовлене його винятковими окисними
властивостями. Озон використовується:
·
для озонування питної води, що значно
ефективніше, ніж хлорування;
·
для знешкодження промислових стічних вод;
·
для очищення та знезараження
повітря;
·
для отримання багатьох
органічних речовин;
·
для відбілювання паперу, тканин, мінеральних масел;
·
для усунення кольору і запаху;
·
для видалення органічних сполук, небезпечних для навколишнього середовища;
·
як дезінфікуючий засіб у медицині;
·
як окисник ракетного палива.
Фізіологічна дія озону: він
отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі
створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою
концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту,
запаморочення, стомленість.
Озоновий шар. Проте озон може бути не лише шкідливим,
а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша,
вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і
восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над
екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням
від поверхні Землі концентрація озону збільшується і досягає максимуму на
висоті 20 — 25 км. Там утворюється так званий озоновий шар . Озоновий шар відіграє значну роль у збереженні життя на
нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину
ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові)
захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання
Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує
збереження життя на Землі.
Завдання
1. Повторите § 18, 21,22,23;
2.
Прочитайте текст «Озон»;
3.
Складіть таблицю« Порівняльна характеристика властивостей кисню та озону»
Властивості
простих речовин
|
Прості
речовини
кисень
|
Прості
речовини
озон
|
Агрегатний
стан за звичайних умов
|
||
Колір
|
||
Запах
|
||
Розчинність
(у 100 об'ємах Н20 при 200С)
|
||
Густина
газу за н. у.
|
||
Температура
кипіння
|
||
Температура
плавлення
|
||
Фізіологічна
дія
|
||
Хімічні
властивості
|
||
Реакційна
здатність
|
4.
Дайте відповіді на запитання.
А).Де в
природі трапляється кисень як проста речовина і до складу яких природних
речовин входить хімічний елемент Оксиген?
Б).Яку
роль відіграє кисень у житті живих організмів?
В).Як
відбувається колообіг кисню в природі?
5.
Запропонуйте заходи, які дозволять підтримувати необхідний відсотковий
вміст кисню у складі повітря
Увага!Робота оформлюється письмово на аркушах, дотримуючись вимог
оформлення письмових робіт, до прикладу:
Робота з хімії
«Колообіг
Оксигену в природі. Озон»
учня (учениці) 7 класу
Артемівської ЗОШ І-ІІІ ступенів
№18
прізвище, ім'я у формі родового відмінка
*******
Домашня робота 7 клас (на
15.03.16)
1. Позначте символ хімічного елемента
Оксигену:
А О; Б О3; В О2; Г О5.
2. Позначте, де у виразі йдеться про
просту речовину, а не про хімічний елемент:
А Оксиген входить до складу води;
Б кисень входить до складу земної кори;
В
Оксиген сприяє колообігу інших елементів;
Г Оксиген входить до складу вуглекислого газу.
3. Позначте фізичні властивості кисню
за звичайних умов:
А газ без запаху і смаку;
Б кристали синього кольору;
В Добре розчиняється у воді;
Г на кисень припадає трохи більше 1/5 об’єму повітря.
4. Позначте оксид, у якого найбільша
відносна молекулярна маса:
А СО; Б SO2;
В N2O; Г Na2O.
5. Позначте умови горіння:
А потрібно залити речовину водою;
Б наявність кисню;
В спрямувати на речовину струмінь вуглекислого
газу;
Г речовина повинна бути газоподібною.
6. Позначте агрегатний стан та колір
продукту реакції горіння магнію в кисні:
А газ без кольору;
Б тверда речовина білого кольору;
В тверда речовина червоного кольору;
Г блакитна рідина.
7. Встановіть відповідність:
Формули оксидів: Назви
оксидів:
1. Р2О5; А фосфор (ІІІ) оксид
2. СаО.
Б сульфур (VІ) оксид
В
купрум (ІІ) оксид
3. Сu2O; Г фосфор (V) оксид
4. SO2. Д
купрум (І) оксид
Е кальцій оксид
8. Допишіть схеми
реакцій за участю кисню, під час яких утворюється оксиди, і перетворіть їх на
хімічні рівняння:
А В + … = В2О3; Б
Н2S + … = … + Н2О;
В РН3 + … = Р2 О5 +
…; Г Li + … =
Li2 O.
*******
Домашнее
задание для 10 класса (1.03.16)
1. Прочитайте
текст
Коррозия
металлов
Примерно 20% железа, ежегодно выплавляемого в мире, разрушается от коррозии.
·
31 января 1951 г. обрушился железнодорожный мост
в Квебеке (Канада ), введенный в эксплуатацию в 1947 г.
·
В1964 г. рухнуло одно из самых высотных
сооружений в мире – 400-метровая антенная мачта в Гренландии.
·
В
20-е годы ХХ в. с одним американским миллионером произошла неприятная история.
По его заказу была построена роскошная яхта “Зов моря”. Для обшивки корпуса
яхты использовался сплав никеля с медью, известный под названием монель-металл.
Этот сплав отличался чрезвычайно высокой стойкостью во многих агрессивных
средах, в том числе и в морской воде. Другие детали корпуса судна были
изготовлены из специальных нержавеющих сталей, т.е. материалов, содержащих
железо. Но когда яхту спустили на воду, она полностью вышла из строя.
Коррозия (от лат. Corrosio -
разъедает) - процесс самостоятельного разрушения металла под воздействием
окружающей среды.
В
зависимости от вызываемых коррозией повреждений поверхности металлов различают
следующие ее виды:
- равномерную (сплошную),
- язвенную,
- точечную (питтинг).
Химическая коррозия Это вид коррозии протекает в средах, непроводящих электрический ток (газ, нефть, керосин ) или при высоких температурах, когда невозможна конденсация воды.В результате химической коррозии происходит переход электронов от восстановителя к окислителю. Если прокалить медную проволоку в пламени, образуется серый налет, это и будет оксид меди. При химической коррозии происходит взаимодействие металла с газами, находящимися в составе среды. Чаще всего это кислород. Металл окисляется, и на его поверхности образуются различные соединения:
4Fe0 +
3O2 —> 2Fe+32O3
2Fe0 +
3O2 + 3SO2 —> Fe2+3(SO4)3
2Zn0 + O2 —> 2Zn+2O
Большинство металлов окисляется
кислородом воздуха, образуя на поверхности оксидные пленки, Если эта пленка
прочная, плотная, хорошо связана с металлом, то она защищает металл от
дальнейшего разрушения. Такие защитные пленки появляются у Zn, Al, Cr, Ni, Sn,
Pb, Nb и др. У железа она рыхлая, пористая, легко отделяется от поверхности
металла и не способна защитить его от дальнейшего разрушения
Электрохимическая коррозия Этот
вид коррозии протекает в среде электролита. Если в среде электролита находится
контактная пара металлов (Cu – Fe ), то ионы более
активного металла – железа переходят в раствор, при этом поверхность железа
заряжается положительно, выполняя роль анода. Электроны с поверхности железа
переходят на поверхность более электроположительного металла – меди. В
результате она заряжается отрицательно, выполняя роль катода. На поверхности
меди восстанавливаются ионы водорода, образуя газообразный водород. Это пример
коррозии, протекающей в кислой среде.Но на поверхности металлических изделий, находящихся в атмосферных условиях, всегда конденсируется влага. Капля воды играет роль электролита, в ней растворен кислород из воздуха. Кислород восстанавливается до гидроксид-ионов, а железо окисляется, переходя в гидроксид железа (II) и гидроксид железа (III). Смесь этих гидроксидов и есть ржавчина
Защита от коррозия.
Зная механизм протекания коррозии и
причины ее возникновения, человек научился защищать металлы от коррозии .
·
Крашение;
·
Эмалироание (не
металлическое покрытие);
·
Металлопокрытие;
·
Легирование – введение
в сплав добавки, в результате образуются коррозийно-стойкие сплавы;
·
Введение в среду
ингибитора – специального вещества, замедляющего скорость коррозии;
Ингибиторы коррозии (нитрит
натрия, хромат и дихромат калия, фосфаты натрия и другие). Защитное действие
этих веществ обусловлено тем, что они адсорбируются на поверхности металла и
каталитически снижают скорость коррозии, а некоторые из них (хроматы и
дихроматы) переводят металл в пассивное состояние.
·
Удаление
растворенного в воде кислорода (деаэрация).
·
Протекторная защита –
присоединение к защищаемому металлу более активного
Протекторная (анодная) – к защищаемой металлической конструкции,
присоединяют кусок более активного металла (протектор), который служит анодом и
разрушается в присутствии электролита, В качестве протектора при защите
корпусов судов, трубопроводов, кабелей и других металлических изделий
используют магний, алюминий, цинк.
Катодная – металлоконструкцию
подсоединяют к катоду внешнего источника тока. Происходит электрозащита –
нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в
противоположном направлении.
Рассмотрим в качестве примера коррозию Железа в растворе соляной кислоты в
контакте с медью.
При этом возникает гальванический элемент. Более активный
металл – железо окисляется и переходит в раствор в виде ионов Fe2+
Fe0 – 2 e →Fe2+
Железо и медь контактируют друг с другом, и
электроны, выделяющиеся при окислении железа, перемещаются на медь, где их и
получает ион водорода. Т.е возникает движение электронов, а это и есть электрический ток.
Ионы же водорода
двигаются к меди (катоду), где, принимая электроны, восстанавливаются:
2H+ +2e → H20
Если электролит имеет нейтральную или щелочную среду, тогда
на катоде протекает процесс восстановления
кислорода, растворенного в электролите:
O2+ 2 H2O +4e→4OH- в этом случае образовавшиеся ионы ОН- соединяются с
перешедшими в раствор ионами железа
Fe2++ 2OH- →Fe(OH)2↓
Fe(OH)2 в присутствии воды и кислорода превращается в Fe(OH)3, который
частично отщепляет воду и образующееся вещество отвечает по составу бурой
ржавчине yFe2O3* xH2O
2. Выполните
Тест
1. Слово “коррозия” в переводе с латинского
означает: и) разрушать; п) окислять; к) разъедать; р) ржаветь.
2. Питтинг - это: ж) электрохимическая коррозия; н)
язвенная коррозия; о) точечная коррозия; р) сплошная коррозия.
3. Окисление металла в среде неэлектролита: а)
электрохимическая коррозия; г) язвенная коррозия; о) точечная коррозия; р)
химическая коррозия.
4. Разрушение металла, находящегося в контакте с
другим металлом в присутствии водного раствора электролита: в) газовая
коррозия; и) химическая коррозия; т) сплошная; р) электрохимическая коррозия;
5. Эмалирование это: б) способ предания красоты
металлическому изделию; е) электрохимический метод защиты металлов от коррозии;
о) защитное неметаллическое покрытие металла; ч) защитное металлическое
покрытие металла.
6. Легирование это: з) специальное введение в
сплав элементов, замедляющих процесс коррозии; и) покрытие железного листа
слоем олова; к) создание контакта с более активным металлом; т) покрытие
металла краской.,
7. Вещества, замедляющие процесс коррозии
называются: и) ингибиторы; о) электроды; н) протекторы; т) краски.
8. Присоединение к защищаемому металлу другого,
более активного металла называется: а) металлопокрытие; о) контактная защита; р)
легирование; я) протекторная защита.
3. Ответьте
на вопросы:
·
На стальной крышке поставлена медная
заклепка. Что разрушится раньше – крышка или заклепка? Почему?
·
Почему луженный (покрытый оловом)
железный бак на месте повреждения защитного слоя быстро разрушается?
·
Требуется скрепить железные детали. Какими
заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию
железа? Ответ обоснуйте.
·
Лист железа, покрытый цинком, и лист
железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии
железо в обоих случаях?
·
Почему интенсивнее коррозируют
автомобили в зимнее время года в городских условиях?
·
Почему сейчас коррозия протекает более
интенсивно, чем раньше, например, в средневековье?
·
Сантехника попросили поставить
водопроводный кран, на стальную трубу. В наличии оказались хромированный и
медный краны. Какой кран лучше выбрать? Аргументируйте ответ.
·
Человек поставил на зуб золотую коронку,
по истечении некоторого времени возникла необходимость в еще одной коронке, но
средств на коронку у него нет. Возможен ли вариант, чтобы поставить на зуб
стальную коронку? Что Вы можете предложить в решении данной проблемы?
*******
7 класс (Домашнее задание на 01.03.16)
Прочитать § 19
Ответить на вопросы
с.142, выполнить задания 6,10
Составить кроссворд,
используя термины: кислород, оксиды,
окисление, горение, взрыв, дыхание
Выполнить домашний
эксперимент "Гашение пламени"
На дно
стакана насыпьте чайную ложку питьевой соды и
добавьте 2— 3 столовые ложки уксуса. Сразу
начинается реакция с бурным выделением
углекислого газа. После того как она закончится
(через 2— 3 мин.), зажгите закрепленную на
проволоке спичку и медленно опускайте ее в стакан. Что
наблюдаете? Опишите свои действия и наблюдения. Сделайте выводы.Результаты занесите в таблицу
Выполнение
опыта
|
Наблюдения
|
Выводы
|
*******
8 клас(01.02.16)
Значення
експериментального методу в хімії
1. Самостійна робота
Варіант І
Завдання
1. Укажіть серед
запропонованих речовин формули солей:
а) Na3РO4;
|
б) Сu(ОН)2;
|
в) Na2SO3;
|
г) Н2CO3.
|
Завдання
2. Серед наведених хімічних реакцій укажіть ті, у результаті яких можна
одержати кислоту:
а) Cu
+ H2SO4;
|
б) NaCl + H2SO4;
|
в) SO3 + H2O;
|
г) K2SO4
+ Н2CO3.
|
Завдання
3. Із запропонованих речовин з водою взаємодіють:
а) MgO;
|
б) H2SO4;
|
в) KNO3 ;
|
г) P2O5.
|
Завдання
4. Фенолфталеїн забарвить у малиновий колір розчин:
а) CuSO4;
|
б) H3PO4;
|
в) NaOH
;
|
г) NaCl.
|
Завдання
5. Напишіть рівняння реакцій, що дозволяють здійснити перетворення:
ВаО → Ва(ОН)2 → Ва(NО3)2
SO3 → Н2SO4 → Na2SO4
2. Дайте визначення:
спостереження, дослід, експеримент, гіпотеза, закон, теорія, якісна реакція.
3. Проведіть домашній
експеримент, складіть план, зробіть висновки.
Від тривалого кип’ятіння води на стінках чайника
з’являється накип – відкладання твердих кальцій та магній карбонатів.
З’ясуйте, як можна усунути накип. Як можна в домашніх
умовах зробити цей дослід? Скористуйтесь набутими знаннями для усунення накипу
вдома.
*******
10 класс (01.02.16)
Общая характеристика металлов. Положение металлов в периодической системе.
1. Ответьте на вопросы викторины – «Знаете
ли вы?»
· Каких
элементов больше в периодической системе элементов Д.И.Менделеева металлов или
неметаллов?
·
В
какой группе расположены самые активные, щелочные металлы? Назовите их.
·
Из
какого металла делают нить лампы накаливания?
·
Какой
металл плавится на ладони рук?
· Самый
распространенный металл земной коры, который применяется в самолетостроении,
производстве линий электропередач, фольги, упаковочного материала.
· Один
из самых широко известных радиоактивных металлов, применяемых на атомных
электростанциях.
·
Металл,
обеспечивающий кроветворение?
·
Металл, вызывающий лихорадку
·
Кто впервые стал применять никель?
·
Какой металл человек обработал первым?
·
Металл, который используют служители церкви для
получения «святой воды»
· Император Наполеон III на банкете велел подать
для почётных гостей приборы из очень дорогого серебристо белого металла. А всем
прочим было обидно до слёз: им пришлось пользоваться обычной золотой и
серебряной посудой. Из чего были изготовлены вилки?
· Известно, что падение Рима вызвано многими социальными,
политическими и экономическими причинами. Но американские учёные – токсикологи
считают, что в падении Рима повинен металл. Он входил в состав посуды,
косметических красок, а также из него были сделаны трубы водопроводов. Люди
вымирали. Империя чахла. Подтверждения учёных подтвердились: обнаруженные
останки древних римлян содержат большое количество этого метала. Какой металл,
по мнению учёных США, повинен в гибели Рима?
· Почему свежий разрез яблока на воздухе постепенно
буреет и приобретает цвет ржавчины?
· Металл,
усиливающий жесткость воды, входящий в состав гигантских сосулек, свисающих с
потолка пещер (сталагмитов и сталактитов), образующий меловые горы, известняки,
мрамор, необходимый для строения костей, повышения мозговой деятельности.
2. Охарактеризуйте положение
металлов в периодической системе
Металлы размещены в ПС …………………………………………………………………………..
В периоде: Заряд ядра атома ………………………………………………………………………………………
Число энергетических уровней в атоме ……………………………………………………
Число электронов во внешнем электронном слое атома ……………………………
Радиус атома … ………………………………………………………………………………………
Металлические свойства атомов ……………………………………………………………….
В главной подгруппе:
Заряд ядра атома … …………………………………………………………………………………………………….
Число энергетических уровней в атоме …………………………………………………………………….
Число электронов во внешних электронных слоях атомов ………………………………………..
Радиус атома …………………………………………………………………………………………………………….
Металлические свойства атомов ……………………………………………………………………………….
3.
Охарактеризуйте физические свойства одного из
металлов
металл
агрегатное состояние
цвет
блеск
тепло- и электропроводность
плотность
твердость
температура плавления
4.
Подготовьте мини-проект «Металлы в нашей жизни»
*******
7 клас (01.02.16)
·
Прочитайте
§19 (стаття «Закон
збереження маси речовин під час хімічної
реакції», с. 111-114
·
Запишіть в зошит
висновки:
1.
Закон збереження
маси ввійшов в історію як закон Ломоносова(1748р.) — Лавуазьє(1789 р.).
2.
Сучасне
формулювання: Загальна маса речовин, що вступили в хімічну реакцію, дорівнює
загальній масі речовин, одержаних у результаті реакції.
3.
Суть хімічного процесу: під час хімічних
реакцій молекули вихідних речовин руйнуються до атомів. Молекули нових речовин
утворюються з тих же атомів, з яких складалися молекули вихідних речовин.
Оскільки кожен атом мае певну масу й атоми під час хімічних реакцій
зберігаються, то й загальні маси речовин до і після реакції будуть рівними.
4.
Значення закону збереження маси речовини:
1) закон підтверджує, що речовини не зникають без сліду й не утворюються
з нічого;
2)
підтверджується висновок про те, що суть хімічних реакцій полягає в
перегрупуванні атомів вихідних речовин й утворенні нових сполук;
3)
завдяки закону можна складати рівняння реакцій і робити за
ними розрахунки;
4) відкриття закону збереження маси
речовин сприяло подальшому розвитку хімічної науки і виробництва, розумінню
законів природи та зв’язку між ними.
·
Самостійна робота
1. Прочитайте текст. Як ви вважаєте, де істина? Дайте обґрунтовану
відповідь.
Знаменитий англійський фізик Р. Бойль, прожарюючи у
відкритій реторті різні метали та зважуючи їх до і після нагрівання, з’ясував,
що масса металів збільшується. Він зробив висновок, що маса речовин у
результаті хімічної реакції змінюється. Р. Бойль стверджував, що існує якась
«вогняна матерія», що в разі нагрівання металу з’єднується з останнім,
збільшуючи його масу.
М. В. Ломоносов, на відміну
від Р. Бойля, прожарював метали не на відкритому повітрі, а в запаяних ретортах
і зважував їх до і після прожарювання. Згідно з цими дослідами, масса речовин
до і після реакції залишалася без змін.
2.
Розв'яжіть
задачі.
Задача
№1. (зразок). Під час розкладання води під
дією електричного струму утворилося 0,6 г водню й 4,8 г кисню. Яка маса води,
що розклалася? Дано:
m (H2) = 0,6 г
m(O2)= 4,8 г
m(H2O) - ?
Рішення:
Виходячи із закону збереження маси речовини маємо: m(H2) + m(O2) = m(H2О), отже m(H2O) = 0,6
+ 4,8 = 5,4 г
Відповідь: m(H2О) =5,4 г
Задача №2. Визначте масу кальцій оксиду, який утворюється при
взаємодії 3,43 г
кисню й 8,57 г
кальцію.
Дано:
m(O2)
=3,43г
m(Са)=8,57 г
m(СаO)=?
Задача №3. Яку масу негашеного вапна було добуто при тривалому прожарю=
ванні 25 г крейди, якщо крім вапна утворилося 11 г вуглекислого газу?
3.
Творче завдання: знайдіть
цікаву інформацію з біографії М.В.
Ломоносова та А. Лавуазьє; з історії
відкриття закону збереження маси.
*******
9
класс (01.02.16)
№1. Прочитайте § 16.Составьте
конспект «Метан и его свойства»
План
|
Характеристика
|
|
Название вещества
|
||
Формула
(молекулярная, структурная, электронная, пространственная)
|
||
Пространственное
строение молекулы
|
||
Распространение
в природе
|
||
Физические
свойства
|
||
Химические
свойства:
|
а)горение;
|
|
б)разложение
при нагревании;
|
||
в)взаимодействие
с хлором; г) взаимодействие с водяным паром
|
||
Получение:
|
а)
лабораторный способ;
|
|
б)промышленный
способ
|
||
Применение
метана
|
||
Интересные
факты о метане
|
||
№2. Прочитайте § 18. Запомните названия и формулы
гомологов метана. Ознакомьтесь с физическими
свойствами алканов. Выполните задания.
Алканы
Гомологи — это вещества, сходные по строению и свойствам и
отличающиеся на одну или более групп СН2.
Гомологический ряд метана составляют предельные (насыщенные) углеводороды или алканы. Общая формула СnН2n+2 ,где n- число атомов Карбона.
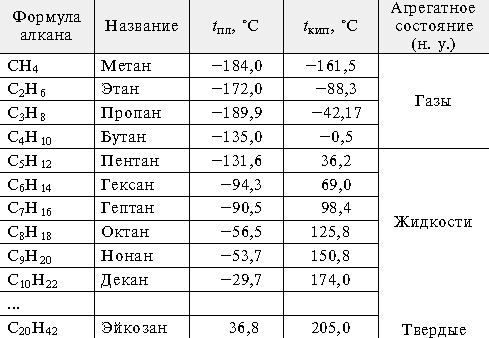
Гомологический ряд метана составляют предельные (насыщенные) углеводороды или алканы. Общая формула СnН2n+2 ,где n- число атомов Карбона.
Молярная масса вычисляется по формуле: М =
14n + 2. Характерная особенность: окончания в их названиях - «-ан»-
Физические свойства
·
не имеют цвета;
·
в воде не растворяются
;
·
температуры плавления и кипения увеличиваются с
увеличением молекулярной массы и длиной главной углеродной
цепи;
·
при нормальных условиях неразветвлённые алканы с CH4 до C4H10
газы; с C5H12 до C13H28 — жидкости;
после C14H30 — твёрдые вещества.
·
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количестватепла.
Задания для самостоятельной работы
Выполните тест:
- Органические вещества-это: а) вещества,полученные из живых организмов, б)соединения Карбона, в)вещества, содержащиеся в растениях, г)соединения, образованные элементами -неметаллами
- К элементам-органогенам относятся:а) все элементы ПС,б)О,Н,Р,F,Mg,Fe, в)С,Н,О,N,S,P,Cl, г)Mg,Fe,Cu,Na,K
- К органическим веществам относятся: а)сахар, белки, мел, б)жир, глюкоза, вода, в) углекислый газ,витамины, пластмасса, г)углеводы, лимонная кислота, спирт
- Органические вещества можно получить: а) выделяя их из природных объектоав, б) получая в лабораторных условиях, в) синтезируя из неорганических соединений, г) выделяя из природных объектах и синтезируя в лабораторных условиях
- Укажите валентность атома карбона в органических соединениях: а) 4, б)3, в)2,г)2или4
- Укажите химические связи, образующиеся между атомами карбона, а также с атомами других элементов в органических соединениях: а)ионные, б)ковалентные полярные, в)водородные, г)ковалентные неполярные
- Назовите последовательную карбоновую цепочку из трех атомов Карбона с одной тройной связью: а)−С≡C−С−, б)−С≡C−,в)−С−С≡C−С−, г)−С−С−С−
- Многообразие органических соединений объясняется:а) особенностями строения атомов Карбона, б) возможностью получать органические вещества искусственным путем, в)наличием элементов-органогенов,г)способностью образовывать ковалентные связи
- По физическим свойствам органические соединения: а)твердые, хорошо растворимые в воде вещества, б)летучие , легкоплавкие соединения,нерастворимые в органических растворителях,в) большинство органических соединений хорошо растворимо в воде, г) летучие, легкоплавкие соединения, хорошо растворимые в ацетоне, спирте, керосине
- Теорию строения органических соединений разработал: а) Менделеев, б)Бутлеров, в)Ломоносов, г)Эйнштейн
Решите
задачу
По
общей формуле составьте молекулярные формулы алканов , где: а) n= 7, б) n= 12, в) n= 4. Вычислите их молярные
массы.
*******
11 класс (01.02.16)
Фамилия
_________________________________________Дата_____________
класс________________
Самостоятельная работа
№1.Прочитайте
§16, проработайте материал таблицы «Классификация волокон», дайте определение
понятию «волокна».
Волокна –
это….
Таблица «Классификация волокон»
Волокна
|
|||
природные
|
химические
|
||
растительного
происхождения
|
животного
происхождения
|
искусственные
|
синтетические
|
Волокна получены из природных высокомолекулярных соединений. В
основе- целлюлоза
|
Волокна получены из природных высокомолекулярных соединений. В
основ е-протеины
|
Волокна получены при химической переработке сырья
растительного или животного происхождения. В основе -природные полимеры
|
Волокна получены в результате органического
синтеза.
В основе - синтетические полимеры
|
Хлопок,
лен, кенаф, джут, пенька, конопля, крапива
|
Шерсть, шелк
|
Вискозное, ацетатное,
медно-аммиачное.
|
Капрон, лавсан, найлон,
хлорин, нитрон.
|
№2.
Заполните таблицу «Важнейшие химические волокна»
Волокно
|
Исходное вещество
|
Получение
|
Достоинства
|
Недостатки
|
Применение
|
Лавсан
(полиэтилентерефталат)
|
Этиленгликоль
HO-CH2CH2-OH
и
двухосновной кислоты -
терефталевой
(1,4-бензолдикарбоновой)
HOOC-C6H4-COOH
|
Получают реакцией
поликонденсации терефталевой кислоты и этиленгликоля:
n HOOC-C6H4-COOH +
n HO-CH2CH2-OH →
→ HO-(-CO-C6H4-CO-O-CH2CH2-O-)n-H
+ (n-1) H2O
|
1. Прочность, износостойкость;
2. Свето- и термостойкость;
3. Хороший диэлектрик;
4. Устойчив к действию растворов кислот и
щелочей средней концентрации;
5. Высокая термостойкость (-70˚ до + 170˚).
|
Негигроскопичен (для производства одежды
используют в смеси с другими волокнами).
|
Для изготовления
*тканей различных типов (тафта, жоржет, креп,
пике, твид, атлас, кружево, тюль, плащевые и т.п.);
*пленок, бутылей, упаковочного материала,
контейнеров и др.;
*транспортёрных лент, приводных ремней,
канатов, парусов, рыболовных сетей и тралов, щёток, застёжек
"молния", струн ракеток и т.п.;
*хирургических нитей и материалов для
имплантации в сердечно-сосудистойсистеме
|
Ацетатное волокно
|
|||||
Вискоза
|
|||||
Кевлар
|
|||||
Нитрон
|
|||||
Лавсан
|
№3. Задания для самоконтроля по теме «Волокна»:
1. Искусственные
волокна – это волокна полученные…: а) из природных полимеров; б) из
синтетических полимеров.
2. Синтетические волокна – это волокна полученные …: а) из природных полимеров; б)
из синтетических полимеров.
3. Синтетическое
волокно- это: а) капрон; б) шерсть; в)
вискоза; г) хлопок.
4. Среди тканей
укажите синтетические: а) хлопок; б) штапель; в) лавсан; г)
капрон.
5.Сырьем для
производства ацетатного волокна служит: а) целлюлоза; б)
шерсть; в) капролактам.
6. Для
искусственных волокон характерна: а) прочность; б)
гигроскопичность; в) способность выдерживать агрессивную среду; г)
мягкость.
7.Установите
соответствие между классификацией волокна и его названием:
Классификация
|
Название
|
1. искусственное волокно
|
а. капрон
|
2. синтетическое волокно
|
б. шелк
|
3. натуральное волокно
|
г. лавсан
|
8. Установите
соответствие:
Волокно
|
Вид остатка после
сжигания волокна
|
Запах при горении волокна
|
1. шерсть
|
а. круглый
твердый шарик, который рассыпается при сдавливании между пальцами
|
А. запах жжёных перьев
|
2. капрон
|
б. пепел серого цвета
|
Б. запах жжёной бумаги
|
3.лен
|
в. пушистая мягкая черная зола
|
В. запах сургуча
|
9.Волокно «Анид»
получают поликонденсацией гексаметилендиамина
NH2–(CH2)6–NH2 і адипиновой кислоты HOOC–(CH2)4–COOH. Составьте уравнение реакции поликонденсации.
NH2–(CH2)6–NH2 і адипиновой кислоты HOOC–(CH2)4–COOH. Составьте уравнение реакции поликонденсации.
10. Напишите уравнение получения волокна
нитрона (из него изготавливают синтетические шубки) реакцией
полимеризации, если мономером является вещество с формулой CH2 = CH(СN)
*******
7 класс
электронный учебник по химии для 7 класса
Попель П.П.,Крикля Л.С.(2015 г)
Прочитать §18 выполнить задания №131-138, с.
110-111;
Подобрать интересные факты о воздухе и кислороде.
8
класс
Учить §18, 19, повторить §15-17
выполнить задания №169,170,174 а,б,в, с. 119; решить задачу № 175, с.120
выполнить задания №169,170,174 а,б,в, с. 119; решить задачу № 175, с.120
9
класс
Повторите §16, Ответьте на вопросы:
- Что изучает органическая химия?
- Охарактеризуйте этапы возникновения органической химии, как науки.
- Какой элемент и почему составляет основу органической химии?
- Какие вещества называют органическими?
- Приведите примеры природных и синтетических органических соединений.
- Что отличает органические вещества от неорганических?
- Почему органических веществ больше, чем неорганических?
Создайте в электронном
варианте презентацию «Органические вещества, применяемые в быту», « История
развития органической химии»
10
класс
Прочитайте §14. Строительные материалы: стекло,
цемент, бетон, их использование.
Ответьте на вопросы с.113
Подготовьте, мини-проект на одну из тем:
Керамика в народных ремеслах Украины
Исторические аспекты варки стекла в Украине (стекло, мозаика, смальты)
11
класс
Повторите тему «Полимеры, пластмассы»§14;
выполните тест «Полимеры»
выполните тест «Полимеры»
1. Полімером,
що не переробляється в природі мікроорганізмами та забруднює навколишнє
середовище, є:
а) поліетилен;
б) целюлоза;
в) білок;
г) крохмаль.
а) поліетилен;
б) целюлоза;
в) білок;
г) крохмаль.
2. Реакція
полімеризації належить до реакцій:
а) обміну;
б) приєднання;
в) розкладу;
г) заміщення.
а) обміну;
б) приєднання;
в) розкладу;
г) заміщення.
3. Укажіть
назву ділянки полімера, що багаторазово повторюється в його молекулі:
а) мономер;
б) полімер;
в) структурна ланка;
г) ступінь полімеризації.
а) мономер;
б) полімер;
в) структурна ланка;
г) ступінь полімеризації.
4. Які
особливості складу і будови молекули мономера зумовлюють можливі реакції
полімеризації і поліконденсації?
5. Назвіть
мономери, із яких утворюються полімери з такими формулами:
а) (–СН2–СН2–);
б) (–СН2–СНCl–);
в) (–СН2–СНC6H5–).
а) (–СН2–СН2–);
б) (–СН2–СНCl–);
в) (–СН2–СНC6H5–).
6. Який
мономер використовується для добування полівінілхлориду:
а) хлороетан;
б) хлоропропан;
в) хлорвініл;
г) дихлороет-1,2-ен.
а) хлороетан;
б) хлоропропан;
в) хлорвініл;
г) дихлороет-1,2-ен.
7. Для
надання пластмасі еластичності, у полімерну масу додають:
а) каталізатори;
б) пластифікатори;
в) наповнювачі;
г) барвники.
а) каталізатори;
б) пластифікатори;
в) наповнювачі;
г) барвники.
8. Напишіть
рівняння реакцій полімеризації пропену.
9. Яка
пластмаса важко загоряється, має здатність до самогасіння і її використовують
як замінник шкіри:
а) поліетилен;
б) поліпропілен;
в) полівінілхлорид;
г) тефлон?
а) поліетилен;
б) поліпропілен;
в) полівінілхлорид;
г) тефлон?
10. Який
полімерний матеріал за його особливу хімічну стійкість називають «органічною
платиною»?
а) поліетилен;
б) поліпропілен;
в) полівінілхлорид;
г) тефлон?
а) поліетилен;
б) поліпропілен;
в) полівінілхлорид;
г) тефлон?
11. Які сполуки можуть вступати в реакцію
полімеризації, а які – в реакцію поліконденсації:
а) етилен;
б) аміноетанова кислота;
в) тетрафлуорометан.
Відповіть підтвердіть рівняннями реакцій.
а) етилен;
б) аміноетанова кислота;
в) тетрафлуорометан.
Відповіть підтвердіть рівняннями реакцій.
12. Установіть
генетичний ланцюжок добування полівінілхлориду:
а) кальцій карбід;
б) кальцій карбонат;
в) хлоретен;
г) ацетилен;
д) кальцій оксид;
е) полівінілхлорид.
а) кальцій карбід;
б) кальцій карбонат;
в) хлоретен;
г) ацетилен;
д) кальцій оксид;
е) полівінілхлорид.
Проработайте материал учебника о природных и синтетических каучуках,§15
Ответьте на вопросы:
- Что такое каучук?
- Какие виды каучуков существуют?
- Где применяют каучуки?

Комментариев нет:
Отправить комментарий